СИНТЕЗ ПИРАЗОЛА И 1,2,3-ТРИАЗОЛА НА ОСНОВЕ N-МАЛЕОПИМАРИМИДЗАМЕЩЕННОЙ АМИНОГЕКСАНОВОЙ КИСЛОТЫ
СИНТЕЗ ПИРАЗОЛА И 1,2,3-ТРИАЗОЛА НА ОСНОВЕ N-МАЛЕОПИМАРИМИДЗАМЕЩЕННОЙ АМИНОГЕКСАНОВОЙ КИСЛОТЫ
Аннотация
Растительные терпены и их производные – это перспективный класс природных соединений, биологическая активность которых изучается учеными по всему миру в течение последних двух десятилетий. Малеопимаровая кислота, получаемая из лесохимического сырья с помощью реакции Дильса-Альдера, является перспективным исходным материалом для синтеза биоактивных веществ. В результате 1,3-диполярного циклоприсоединения диазометана и метил-2-азидоацетата к алленоату, полученного из производной малеопимаримидзамещенной аминогексановой кислоты в условиях реакции Виттига, нами впервые получены гибридные потенциально биоактивные соединения, содержащие дитерпеновый остаток и фармакофорные пиразольное и триазольное кольца. Показано, что взаимодействие диазометана с 1,2-диеноатом в присутствии триэтиламина протекает региоспецифично только по одной кратной связи алленового фрагмента, сопряженного со сложноэфирной группой.
1. Введение
Исследования биоактивности растительных терпенов и их производных, активно проводимые в течение последних двадцати лет , демонстрируют значительный потенциал этого класса природных соединений. Особое внимание привлекает малеопимаровая кислота (1) (МПК) – легкодоступное вещество, получаемое из возобновляемого лесохимического сырья путем реакции Дильса-Альдера левопимаровой кислоты с 2,5-фурандионом . Молекула МПК, содержащая гидрофенантреновое кольцо, двойную связь, карбоксильную и ангидридную группы, находит широкое применение в производстве лакокрасочных материалов и полимеров , . Кроме того, она рассматривается как перспективный исходный материал для получения биологически активных соединений , , и хиральных лигандов . Данное исследование посвящено синтезу потенциально биоактивных соединений через 1,3-диполярное циклоприсоединение диазометана и метил-2-азидоацетата к алленоату, полученному из N-малеопимаримидзамещенной аминогексановой кислоты.
2. Методы и принципы исследования
ИК спектры записывали на приборе IR-Prestige-21 (Fourier Transform Spectrophotometer – Shimadzu) в тонком слое или вазелиновом масле. Спектры ЯМР были получены на спектрометре Bruker-AM 500 с рабочей частотой 500.13 МГц (1Н), 125.76 МГц (13С), внутренний стандарт – тетраметилсилан (ТМС). Для корректного отнесения сигналов в спектрах ЯМР для продуктов реакций применялись методы гомо- и гетероядерной двумерной корреляции COSY, NOESY, HSQC и HMBC. За ходом реакции следили при помощи использования тонкослойной хроматографии на пластинках Sorbfil ПТСХ-АФ-А, вещества обнаруживали с помощью УФ-облучения, паров йода, опрыскивания пластинок раствором нингидринового проявителя с последующим нагреванием при 100-110°С. Элементный анализ был сделан при помощи прибора EURO EA-3000 CHN. Продукты реакции выделяли при помощи колоночной хроматографии на силикагеле «Chemapol» с размером частиц 40/100 мкм и 100/160 мкм.
Данные элементного состава всех соединений соответствовали вычисленным.
Метиловый эфир малеопимаровой кислоты получали по известной методике , физико-химические характеристики соответствовали литературным данным. Кислоту 1 синтезировали по методике, которая была описана в работах , . Получение метил-2-азидоацетата описано в .
2.1. Мeтил-12-изопропил-2-(8'-метокси-8'-оксоокта-5',6'-диен-1'-ил)-6,9a-диметил1,3-диоксогексадекагидро-3b,11-этенонафто[2,1-e]изоиндол-6-карбоксилат (4)
Выход 70%. Прозрачный маслообразный продукт. ИК (в.м.) ν см-1: 1695, 1767, 1960. ЯМР 1H (CDCl3, δ м.д., J/Hz): 0,57 (с, 3H, H-17), 0,89 и 0,93 (д, 6H, J = 6,8, Н-15, 16), 0,96 и 1,42 (м, 2H, H-9), 1,12 (с, 3H, H-18), 1,18 и 1,46 (м, 2H, H-5), 1,22 и 1,53 (м, 2H, 93 H-10), 1,35 (м, 1H, H-9b); 1,47-1,53 (м, 2H, H-8), 1,50 и 1,63 (м, 2H, H-7), 1,60 и 2,47 (м, 1H, H-4), 1,67 (м, 1H, H-5a), 1,72 (м, 2Н, H-3'), 1,75 (м, 2Н, H-2'), 2,10 (м, 1H, J = 6,8, H-14), 2,15 (м, 2Н, Н-4'), 2,38 (д, 1H, J = 8,0, H-3a), 2,75 (дд, 1H, J = 8,0, J = 2,9, H-11a), 3,03 (с, 1H, H-11), 3,30 (т, 2H, J = 7,1, H-1'), 3,65 (с, 3H, H-20), 3,70 (с, 3H, H9'), 5,37 (с, 1H, H-13), 5,56 (с, 1Н, Наллен-7'), 5,58 (т, 1H, J = 7,6, Hаллен-5'). ЯМР 13C (CDCl3, δ м.д.): 15,63 (C17), 16,73 (C18), 17,03 (C8), 19,83 (C15), 20,63 (C16), 21,76 (C5), 25,82 (C3'), 26,87 (C2'), 27,11 (C4'), 27,53 (C10), 32,58 (C14), 35,28 (C4), 35,63 (C11), 36,71 (C7), 37,67 (C9a), 37,86 (C1'), 38,14 (C9), 40,71 (C3b), 44,92 (C11a), 47,13 (C6), 49,53 (C5a), 51,90 (C20), 51,96 (С9'), 52,28 (C3a), 54,24 (C9b), 88,12 (C5' аллен), 94,82 (С7'аллен), 124,32 (C13), 146,94 (C12), 166,47 (C8'), 177,31 (C3), 178,49 (C1), 179,14 (C19), 212,30 (C6'). С34Н47NO6. Масс-спектр: m/z 566[MH] + . Вычислено М 565.
2.2. Мeтил-12-изопропил-2-(8'-метокси-8'-оксоокта-5',6'-диен-1'-ил)-6,9a-диметил1,3-диоксогексадекагидро-3b,11-этенонафто[2,1-e]изоиндол-6-карбоксилат (5)
К охлажденному раствору алленоата (0,5 г) в 20 мл дихлорметана, поддерживаемому при 0°C, добавили эквимолярное количество триэтиламина. После этого ввели пятикратный избыток свежеприготовленного раствора диазометана в дихлорметане и постепенно довели температуру смеси до комнатной. Реакционную массу перемешивали с помощью магнитной мешалки при комнатной температуре в течение 6 часов. После удаления растворителя путем выпаривания конечные продукты выделили с помощью колоночной хроматографии на силикагеле, используя смесь петролейного эфира и этилацетата (3:1) в качестве элюента.
Выход 46%. Прозрачный маслообразный продукт. ИК (в.м.) ν см-1 : 1695, 1767, 1960. ЯМР 1H (CDCl3, δ м.д., J/Hz): 0,57 (с, 3H, H-17), 0,89 и 0,93 (д, 6H, J = 6,8, Н-15, 16), 0,96 и 1,42 (м, 2H, H-9), 1,12 (с, 3H, H-18), 1,18 и 1,46 (м, 2H, H-5), 1,22 и 1,53 (м, 2H, 93 H-10), 1,35 (м, 1H, H-9b); 1,47-1,53 (м, 2H, H-8), 1,50 и 1,63 (м, 2H, H-7), 1,60 и 2,47 (м, 1H, H-4), 1,67 (м, 1H, H-5a), 1,72 (м, 2Н, H-3'), 1,75 (м, 2Н, H-2'), 2,10 (м, 1H, J = 6,8, H-14), 2,15 (м, 2Н, Н-4'), 2,38 (д, 1H, J = 8,0, H-3a), 2,75 (дд, 1H, J = 8,0, J = 2,9, H-11a), 3,03 (с, 1H, H-11), 3,30 (т, 2H, J = 7,1, H-1'), 3,65 (с, 3H, H-20), 3,70 (с, 3H, H9'), 5,37 (с, 1H, H-13), 5,56 (с, 1Н, Наллен-7'), 5,58 (т, 1H, J = 7,6, Hаллен-5'). ЯМР 13C (CDCl3, δ м.д.): 15,63 (C17), 16,73 (C18), 17,03 (C8), 19,83 (C15), 20,63 (C16), 21,76 (C5), 25,82 (C3'), 26,87 (C2'), 27,11 (C4'), 27,53 (C10), 32,58 (C14), 35,28 (C4), 35,63 (C11), 36,71 (C7), 37,67 (C9a), 37,86 (C1'), 38,14 (C9), 40,71 (C3b), 44,92 (C11a), 47,13 (C6), 49,53 (C5a), 51,90 (C20), 51,96 (С9'), 52,28 (C3a), 54,24 (C9b), 88,12 (C5' аллен), 94,82 (С7'аллен), 124,32 (C13), 146,94 (C12), 166,47 (C8'), 177,31 (C3), 178,49 (C1), 179,14 (C19), 212,30 (C6').
2.3. Meтил-12-изопропил-2-{5''-[4'-(метоксикарбонил)-1'-(2'-метокси-2'-оксоэтил)-1'H-1',2',3'-триазол-5'-ил]пентил}-6,9a-диметил-1,3-диоксогексадекагидро-3b,11-этенонафто[2,1-e]изоиндол-6-карбоксилат (6)
0,01 Моль аллена и 0,02 моль метил-2-азидаацетата кипятили в 15 мл толуола в течение 10 ч. Затем реакционную массу упарили, остаток хроматографировали на силикагеле (петролейный эфир – этилацетат 2:1).
Выход 40%, маслообразное вещество желтого цвета. ИК ν см-1: 1244, 1373, 1401, 1437, 1693, 1721, 1755. ЯМР 1H (CDCl3, δ м.д., J/Hz): 0,55 (с, 3H, H-17), 0,87 (д, 3H, J = 6,6, H-15), 0,91 (д, 3H, J = 6,6, H-16), 0,94 (м, 1H, Hax-9), 1,11 (с, 3H, H-18), 1,15 (м, 1H, Heq-5), 1,18 (м, 2Н, H-2''), 1,23 (м, 1H, Heq-10), 1,37 (м, 1H, H-9b), 1,42 (м, 1H, Heq-9), 1,47-1,55 (м, 2H, Hгем-8), 1,48 (м, 1H, Hax-5), 1,51 (м, 1H, Heq-7), 1,54 (м, 2Н, H-3''), 1,57 (м, 1H, Hax-10), 1,60 (м, 1H, Hax-4), 1,63 (м, 1H, Hax-7), 1,66 (м, 2Н, H-4''), 1,73 (м, 1H, H-5a), 2,11 (м, 1H, J = 6,8, H-14), 2,38 (д, 1H, J = 8,1, H-3a), 2,45 (м, 1H, Heq-4), 2,73 (дд, 1H, J = 8,1, H-11a), 2,88 (т, 2H, J = 8, H-5''), 3,00 (с, 1H, H-11), 3,28 (т, 2H, J = 7,1, H-1''), 3,63 (с, 3H, H-20), 3,77 (с, 3H, H-10'), 3,92 (с, 3H, H-8'), 5,15 (с, 2H, H-6'), 5,30 (с, 1H, H-13). ЯМР 13C (CDCl3, δ м.д.): 15,63 (C17), 16,72 (C18), 17,00 (C8), 19,84 (C15), 20,63 (C16), 21,09 (C2''), 21,76 (C5), 22,93 (C5''), 26,14 (C3''), 27,28 (C4''), 27,51 (C10), 32,59 (C14), 35,27 (C4), 35,62 (C11), 36,70 (C7), 37,48 (C1''), 37,66 (C9a), 38,09 (C9), 40,69 (C3b), 44,90 (C11a), 47,12 (C6), 48,74 (С6'), 49,48 (C5a), 51,96 (C20), 52,00 (С10'), 52,26 (C3a), 53,15 (С8'), 54,18 (C9b), 124,26 (C13), 136,12 (С4'), 143,23 (С5'), 146,94 (C12), 161,73 (С9'), 166,31 (С7'), 177,63 (C3), 178,64 (C1), 179,23 (C19). C37H52N4O8. Масс-спектр: m/z 681 [MH]+, 679 [MH]-. Вычислено М 680.
3. Основные результаты
Хлорангидрид кислоты 2, который был полученный из метилмалеопимаримидной кислоты 1 реакцией с оксалилхлоридом, под действием триэтиламина превращается в кетен 3. Взаимодействие последнего in situс метил(трифенилфосфоранилиден)ацетатом в реакции олефинирования по Виттигу приводит к образованию алленоата 4 с выходом 70%. Структура полученных соединений подтверждена методами физико-химического анализа. Структуры полученных соединений доказаны с помощью физико-химических методов анализа. Для алленоата 4 в спектре ЯМР 13С информативными являются сигналы двух терминальных алленовых углеродных атомов при δс 88,15 и 94,82 м.д., и центрального алленового углеродного атома, проявляющийся в слабом поле при δс 212,30 м.д. В спектре ЯМР 1Н сигнал протона алленового фрагмента идентифицируется при δн 5,5 м.д.
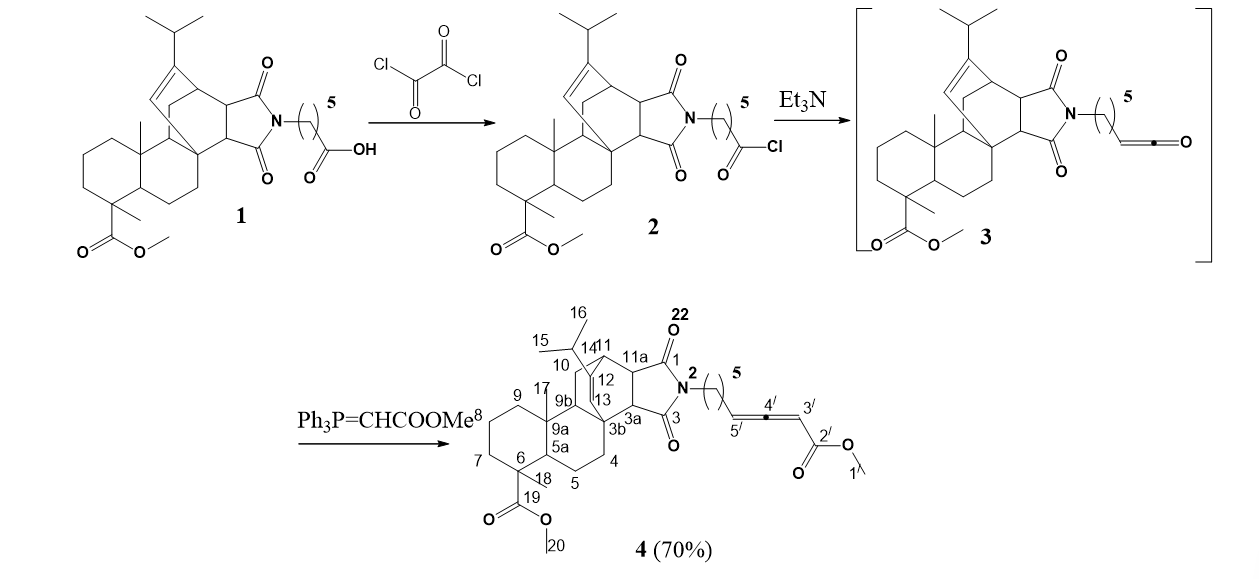
Рисунок 1 - Получение алленоата 4
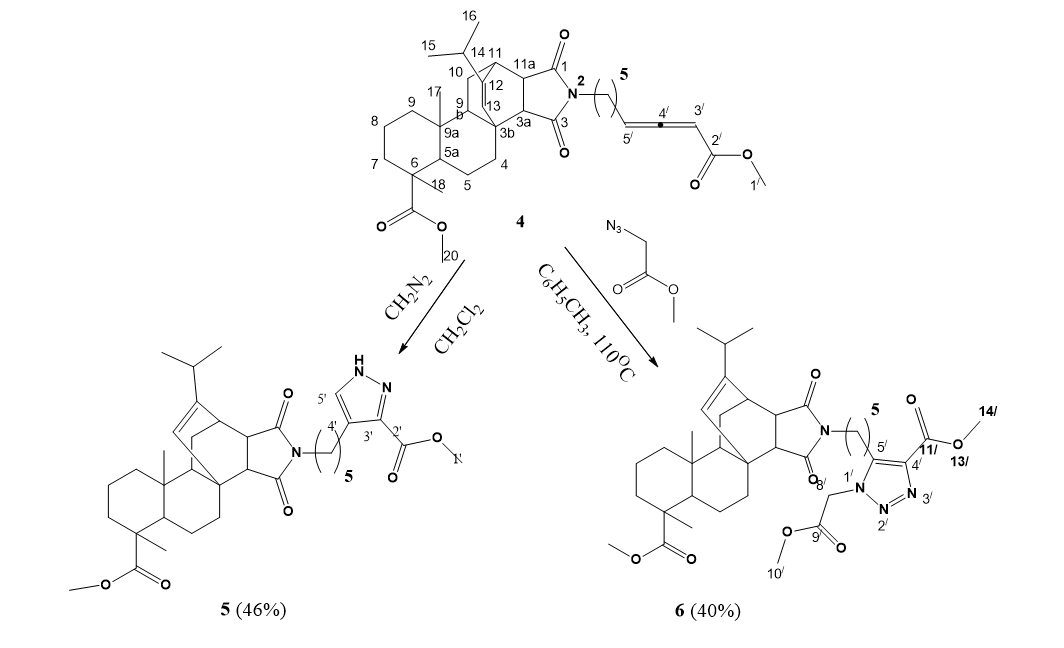
Рисунок 2 - Получение пиразола 5 и триазола 6 из алленоата 4
4. Заключение
Таким образом, нами впервые синтезированы гибридные соединения, которые содержат дитерпеновый остаток и фармакофорные пиразольное и триазольное кольца путем 1,3-диполярного циклоприсоединения диазометана или метил-2-азидоацетата к алленоату, полученного из N-малеопимаримидзамещенной аминокислоты.
