Формирование гомологических серий химических соединений в системах (Ir4+ – Ir5+ – O2–), (Ca2+ – Ir5+ –O2–) и (Ca2+ – Ir4+ – O2–) на базе соединений Ir4+5Ir5+4O20, Ca5Ir5+2O10, и Ca2Ir4+O4
Формирование гомологических серий химических соединений в системах (Ir4+ – Ir5+ – O2–), (Ca2+ – Ir5+ –O2–) и (Ca2+ – Ir4+ – O2–) на базе соединений Ir4+5Ir5+4O20, Ca5Ir5+2O10, и Ca2Ir4+O4
Аннотация
В работе представлен упрощенный расчет формул гомологических серий химических соединений трех компонентных систем (Ir4+ – Ir5+ – O2–), (Ca2+ – Ir4+ – O2–) и (Ca2+ – Ir5+ – O2–). Формулы полученных расчетом шести гомологических серий имеют следующий вид: Ir4+5nIr5+4O10n + 10, Ir4+5Ir5+4nO10n + 10, Ca2Ir4+n O2n + 2, Ca2nIr4+O2n + 2, Ca5Ir5+2nO5n + 5 и Ca5nIr5+2O5n + 5. Расчет гомологических серий трех компонентных систем произведен на базе соединений Ir4+54 Ir5+4O20, Ca5Ir5+2O10 и Ca2Ir4+ O4, которые участвуют в образовании четырех компонентного соединения Ca10Ir4+5Ir5+4O30. Рассчитанные формулы гомологических серий потенциально дают возможность улучшить характеристики уже известных трех компонентных катализаторов, например, Ca2Ir4+O4, Ca2Ir4+2O6 и Ca4Ir4+O6.
1. Введение
Химические соединения (ХС) используются в большинстве различных приборов. Как известно, любое многокомпонентное ХС является членом какой-нибудь гомологической серии (ГС) с n ≥ 1. Фундаментальные характеристики гомологов одной и той же ГС изменяются закономерно, что является важным фактором для изучения ГС. При использовании этой особенности ГС у исследователей появляется возможность везти поиск новых ХС-гомологов, свойства которых могут оказаться лучше, чем у известного ХС, который уже используется в каком-либо приборе.
Известны, например, экспериментально полученные ХС, описываемые формулами, которым свойственно закономерное изменение состава:
– известны «фазы Магнели»: MenO3n – 1, WnO3n – 2
. Следует заметить, что при условии соблюдения электро нейтральности формул ХС во всех кристаллических решетках ХС, описываемых формулами из , , , , которые относятся к «фазам Магнели», должны присутствовать два разно валентных одноименных катиона: MenO3n – 1, WnO3n – 2 (M ≡ Mo, W, Re), где n = 20, 38-40) и MnO2n – 1 (M ≡ Ti, V) , , ;– известны фазы систем (La-Ni-O), (La-Cu-O)
, , , , , (Sr-Ru-O) , составы которых обобщены авторами в виде формул ГС;– известны «фазы Андерсона» M+4Ti4+nO2(n + 1), где (M+ ≡ Li+, Na+, K+, Rb+, Cs+ и n = 1-9)
;– известна формула ГС системы (Fe2+– Fe3+– O2-): nFeO∙mFe2O3, где (n = 1-4, 6)
;– известна формула ГС системы (Sr2+– Ti4+– O2-)
;– известна формула ГС системы (Ba2+– Cu2+– O2–)
, .Однако, как показано в работах
, , , , составы, обобщенные авторами в приведенных ранее работах формулами, якобы относящимися к ГС, к сожалению, не относятся к последним по следующим причинам: представленные формулы не электро-нейтральны, так как в них отсутствуют одноименные разно валентные химические элементы (ХЭ). Кроме этого в основном это вызвано отсутствием знаний законов формирования ГС.В работах , , , впервые были разработаны основы формирования формул ГС для трех компонентных систем ионов ХЭ, (Aa+ – Bb+ – Cc-), в обобщенном виде, которые впоследствии были развиты для четырех компонентных систем (Aa+ – Bb+ – Dd+ – Cc-) , и для пяти компонентных систем (Aa+ – Bb+ – Dd+ – Ff+ – Cc-) , , , . Кроме этого, для четырех- и пяти компонентных систем в работе показано, что ГС могут развиваться только в сторону двух компонентных ХС (ДХС), а в сторону трех компонентных ХС (ТХС) – ГС не могут развиваться. Разработанный способ расчета формул ГС использовался в ряде работ применительно к различным конкретным системам ионов ХЭ: (Na+ – TI4+ – O2-), (Li+ – Ti4+ – O2–), (K+ – V5+ – O2–), (Ba2+ – Cu2+ – O2–){Li+ – Fe2+ – (PO4)3-}, (Zn2+ – Ge4+ – P3-) , , .
Рассчитанные в работах , формулы ГС системы (M+– Ti4+– O2-), где M+ ≡ Li+, Na+, K+, полностью совпадают с формулой ГС, полученной только на основе экспериментов в .
Соединения пирохлора иридия (Na, Ca)2- x(Ir2 – yMy)O6, где (M = Sb, Zr, Ru, Rh), в частности, соединение Ca2-xIr2O6∙nH2O проявляют высокую электро каталитическую активность при выделении кислорода из водных в сильно кислотных условиях при ~80 oC с сохранением стабильности структуры , . Авторы работ , обнаружили в кристаллической решетке Ca5Ir3O12 присутствие ионов Ir4+ и Ir5+ в соотношении ½. Следуя работам , и соблюдая электро нейтральность формулы соединения Ca5Ir3O12 правильно записать так: Ca5Ir3O12 ≡ Ca5Ir4+Ir5+2O12 . По этой причине, при поиске новых соединений в системе (кальций-иридий-кислород), которой принадлежит соединение Ca5Ir4+Ir5+2O12, с помощью формул ГС химических соединений, необходимо эту систему ХЭ представлять как четырех компонентную систему ионов (Ca2+– Ir4+– Ir5+– O2-) в виде треугольной пирамиды , . Учитывая большой интерес к соединению Ca5Ir4+Ir5+2O12 как к катализатору, в работе были рассчитаны формулы ГС химических соединений системы (Ca2+– Ir4+– Ir5+– O2-) на базе этого четырехкомпонентного соединения, Ca5Ir4+Ir5+2O12: Ca7n - 2Ir4+Ir5+2O7n + 5, Ca5Ir4+5n - 4Ir5+2O10n + 2, Ca25Ir4+5Ir5+14n - 4O35n + 25. Расчет ГС системы (Ca2+– Ir4+– Ir5+– O2-) оказался возможным при ее представлении треугольной пирамидой, в углы основания которой помещены ионы Ca2+,Ir4+ и Ir5+, а в вершине – O2- .
Формирование трех- и четырех компонентных ГС системы (Ca2+– Ir4+– Ir5+– O2-) можно представить, если выявить закономерности химических взаимодействий химических компонент этой системы. Это удается осуществить, если сначала рассмотреть в трех компонентных подсистемах (Ca2+– Ir4+– O2-), (Ca2+– Ir4+– O2-) и (Ir4+– Ir5+– O2-) цепь последовательно протекающих химических взаимодействий начиная с образования окислов CaO, IrO2 и Ir2O5. При этом, следует учесть существование соединений Ca2Ir4+O4, Ca2Ir4+2O6 и Ca4Ir4+O6, которые известны как термо- и кислотоустойчивые катализаторы для выделения кислорода в кислой среде , , .
Как показывают работы , , , геометрические особенности треугольника и треугольной пирамиды дают возможность из всех выявленных химических реакций определить те, которые ответственны за формирование ГС.
Так, для системы (Ca2+– Ir4+– Ir5+– O2-) интересно проследить процесс формирования не только четырех компонентных ГС, но и ГС трех компонентных подсистем (Ca2+– Ir4+– O2-), (Ca2+– Ir5+– O2-) и (Ir4+– Ir5+– O2-), так как гомологи трех компонентных ГС (ТГС) участвуют в формировании четырех компонентных ГС (ЧГС) , , .
Цель работы: рассчитать формулы ГС ХС трех компонентных подсистем (Ir4+ – Ir5+ – O2–), (Ca2+ – Ir5+ – O2–) и (Ca2+ – Ir4+ – O2–).
2. Основная часть
При определении схемы формирования ГС системы (Ca2+ – Ir4+ – Ir5+ – O2-) необходимо сначала рассмотреть трех компонентные подсистемы (Ir4+– Ir5+– O2–), (Ca2+– Ir5+– O2–) и (Ca2+– Ir4+– O2–), так как они являются боковыми гранями треугольной пирамиды и члены ТГС участвуют в формировании четырех компонентных ГС , , .
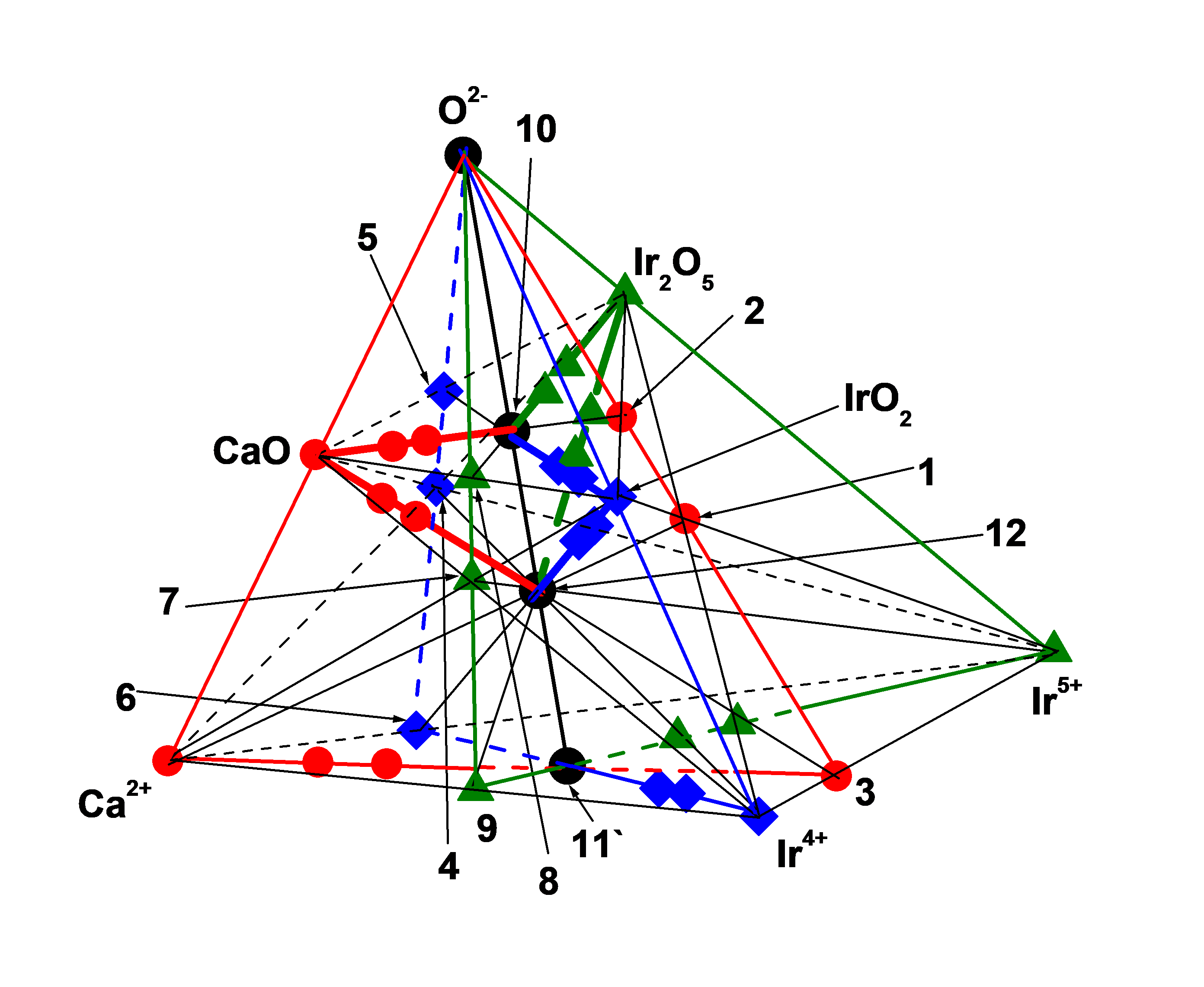
Рисунок 1 - Система (Ca2+ – Ir4+ – Ir5+ – O2-)
т. 1 = [Ir4+5Ir5+4O10]20+, т. 2 = Ir4+5Ir5+4O20, т. 3 = [Ir4+5Ir5+4]40+, т. 4 = [Ca5Ir5+2O5]10+,
т. 5 = Ca5Ir5+2O10, т. 6 = [Ca5Ir5+2]20+, т. 7 = ([Ca2Ir4+O2]4+ т. 8 = Ca2Ir4+O4,
т. 9 = [Ca2Ir4+]8+, т. 10 = ЧХСn(bas) = 1 = Ca20Ir4+10Ir5+8O60 ≡ Ca10Ir4+5Ir5+4O30,
т. 11 = [Ca10Ir4+5 Ir5+4]60+, т. 12 = ЧХСn(bas) = 1 = [Ca20Ir4+10 Ir5+8O20]80+,
т. 13 = [Ca30Ir4+5 Ir5+4O30]40+, т. 14 = Ca30Ir4+5 Ir5+4O50, т. 15 = [Ca30Ir4+5 Ir5+4]100+,
т. 16 = [Ca10Ir4+15Ir5+4O30]40+, т. 17 = Ca10Ir4+15Ir5+4O50, т. 18 = [Ca10Ir4+15Ir5+4]100+.
При решении поставленной задачи рассматривается цепь последовательно протекающих химических взаимодействий начиная с образования активированных окислов Ir2O5, IrO2 и CaO, которые могут взаимодействовать друг с другом с образованием ряда ТХСn ≥ 1 — гомологов различных ТГС. На рис. 1–4 взаимодействия ДХС-окислов друг с другом представляются отрезками (Ir2O5 – IrO2), (IrO2 – CaO) и (Ir2O5 – CaO).
В трех компонентных подсистемах ионов ХЭ ДХС-окислы могут также взаимодействовать с недостающим в их составе положительно заряженным ионом ХЭ с образованием трех компонентных заряженных кластеров (ТЗКn ≥ 1) (рис. 1–4).
В свою очередь, следуя последовательности чередования протекающих взаимодействий, ТЗКn ≥ 1 могут окисляться образуя ТХСn ≥ 1 — гомологи (рис. 1–4).
Эти же ТХСn ≥ 1, как сказано выше, могут также образоваться в результате химического взаимодействия ДХС-окислов друг с другом в соответствии с рассматриваемой системой ионов ХЭ.
Рассматриваемые выше взаимодействия представляются в треугольниках (Ir4+ – Ir5+ – O2-), (Ca2+ – Ir5+ – O2-) или (Ca2+ – Ir4+ – O2-) соответствующими отрезками: (Ir2O5 – IrO2), (IrO2 – Ir5+), (Ir2O5 – Ir4+), (CaO – Ir2O5), (CaO – Ir5+), (Ir2O5 – Ca2+), (CaO – IrO2), (CaO – Ir4+), (IrO2 – Ca2+) на рис. 1-4.
2.1. Трехкомпонентные подсистемы
Как отмечалось выше, для расчета формул ЧГС необходимо вначале рассмотреть схемы формирования ТГС в подсистемах (Ca2+ – Ir4+ – O2-), (Ca2+ – Ir5+ – O2-) и (Ir4+ – Ir5+ – O2-) на рис. 1-4.
2.1.1. Подсистема (Ca2+ – Ir5+ – O2-)
Следуя последовательному чередованию взаимодействий в подсистеме (Ca2+ – Ir4+ – O2-) можно увидеть, что кластер CaO реагируя с Ir5+, а кластер Ir2O5 реагируя с Ca2+ образуют один и тот же кластер ([Ca5Ir5+2O5]10+ = ТЗКn(bas) = 1 = т. 4) на рис. 1, 2.
В свою очередь, кластеры ([Ca5Ir5+2O5]10+ = ТЗКn(bas) = 1 = т. 4) и ([Ca5Ir5+2]20+ = ДЗКn(bas) = 1 = т. 6) окисляясь образуют кластер (Ca5Ir5+2O10 = ТХСn(bas) = 1 = т. 5) на рис. 1, 2:
В подсистеме (Ca2+ – Ir5+ – O2-) базовый кластер (Ca5Ir5+2O10 = ТХСn(bas) = 1 = т. 5) взаимодействуя с Ir5+ начинает формировать αm-ГС-1 (направление Ir2O5), а реагируя с Ca2+ начинает формировать αp-ГС-2 (направление CaO) на рис. 1, 2.
2.1.1.1. Направление Ir2O5
Взаимодействие базового кластера (Ca5Ir5+2O10 = ТХСn(bas) = 1 = т. 5) с Ir5+ и взаимодействие Ca2+ c Ir2O5 производят второй гомолог αm-ГС-1 ([Ca5Ir5+4O10]10+ = ТЗКn(bas) + 1 = 2 = т. 19), который окисляясь образует второй гомолог той же ГС-1 (Ca5Ir5+4O15 =ТХСn(bas) + 1 = 2 = т. 20) на рис. 2:
Гомологическая разница Δ для αm-ГС-1 определится так:
Так как (ТХСn = ТХСn = 1 + k∙Δ), (ТХСn = 1 = ТХСn(bas) – kbas∙Δ) и (n(bas) = kbas + 1), то выясняется, что при определении ТХСn = 1, вычитать формулу (Δ = Ir2O5) из формулы (Ca5Ir5+2O10 = ТХСn(bas) = 1 = т. 5) нельзя. Следовательно, kbas = 0 и n(bas) = 1. Тогда получим формулу αm-ГС-1:
2.1.1.2. Направление CaO
Взаимодействие базового кластера (Ca5Ir5+2O10 = ТХСn(bas) = 1 = т. 5) с Ca2+ и взаимодействие CaO c Ir5+ производят второй гомолог αp-ГС-2 ([Ca10Ir5+2O10]10+ = ТЗКn(bas) + 1 = 2 = т. 22), который окисляясь образует второй гомолог той же ГС-2 (Ca10Ir5+2O15 = ТХСn(bas) + 1 = 2 = т. 23) на рис. 2:
Гомологическая разница Δ для αp-ГС-2 определится так:
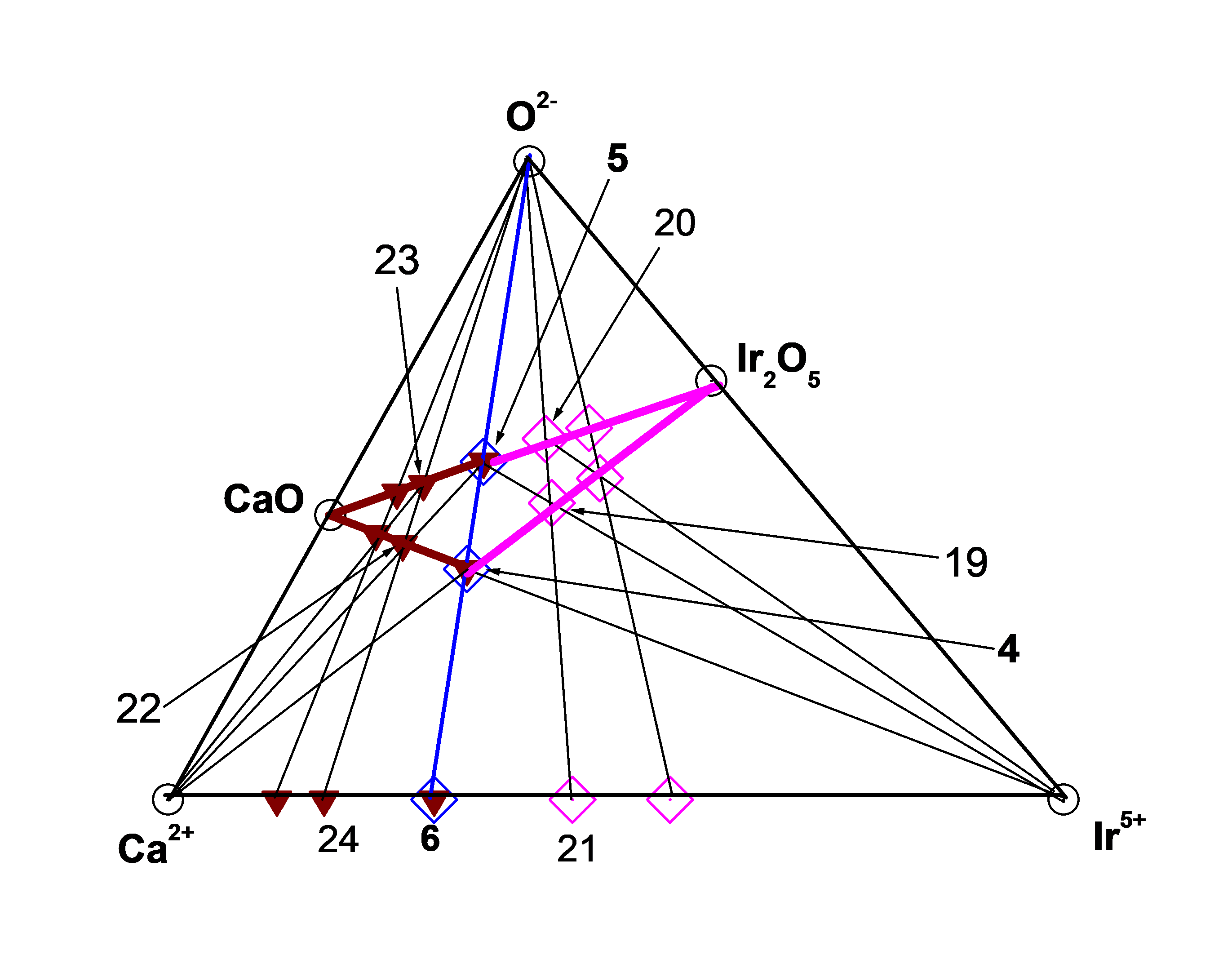
Рисунок 2 - Подсистема (Ca2+ – Ir5+ – O2–)
т. 4 = ТЗКn(bas) = 1 = Ca5Ir5+2O5]10+, т. 5 = ЧХСn(bas) = 1 = Ca5Ir5+2O10, т. 6 = [Ca5Ir5+2]20+,
т. 19 = [Ca5Ir5+4O10]10+, т. 20 = Ca5Ir5+4O15, т. 21 = [Ca5Ir5+4]30+, т. 22 = [Ca10Ir5+2O10]10+,
т. 23 = Ca10Ir5+2O15, т. 24 = [Ca10Ir5+2]30.
Так как (ТХСn = ТХСn = 1 + k∙Δ), (ТХСn = 1 = ТХСn(bas) – kbas∙Δ) и (n(bas) = kbas + 1), то выясняется, что при определении ТХСn = 1, вычитать формулу (Δ = Ca5O5) из формулы (Ca5Ir5+2O10 = ТХСn(bas) = 1 = т. 5) нельзя. Следовательно, kbas = 0 и n(bas) = 1. Тогда получим формулу αp-ГС-2:
2.1.2. Подсистема (Ca2+ – Ir4+ – O2-)
В подсистеме (Ca2+ – Ir4+ – O2-) кластер CaO реагируя с Ir4+, а кластер IrO2 взаимодействуя с Ca2+ образуют один и тот же кластер ([Ca2Ir4+O2]4+ = ТЗКn(bas) = 1 = т. 7). В свою очередь, кластеры ([Ca2Ir4+O2]4+ = ТЗКn(bas) = 1 = т. 7) и ([Ca2Ir4+]8+ = ДЗКn(bas) = 1 = т. 9) окисляясь образуют кластер (Ca2Ir4+O4 = ТХСn(bas) = 1 = т. 8) на рис. 1, 3:
В подсистеме (Ca2+ - Ir4+ - O2-) кластер (Ca2Ir4+O4 = ТХСn(bas) = 1 = т. 8) взаимодействуя с Ir4+ начинает формировать αm-ГС-3, а реагируя с Ca2+ начинает формировать αp-ГС-4 на рис. 1, 3:
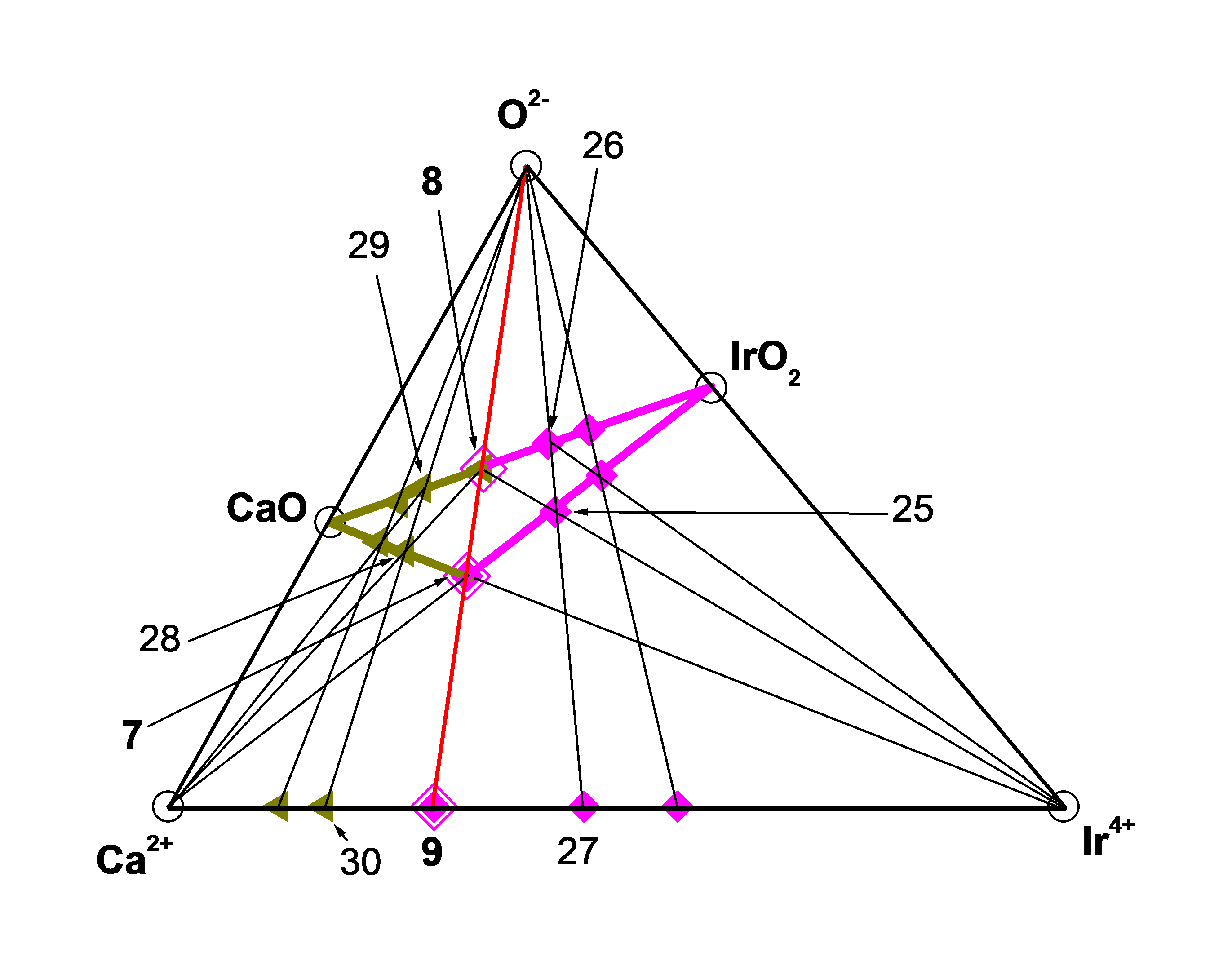
Рисунок 3 - Подсистема (Ca2+ – Ir4+ – O2–)
т. 7 = ТЗКn(bas) = 1 = [Ca2Ir4+O2]4+, т. 8 = ТХСn(bas) = 1 = Ca2Ir4+O4, т. 9 = [Ca2Ir4+]8+,
т. 25 = [Ca2Ir4+2 O4]4+, т. 26 = Ca2Ir4+2O6, т. 27 = [Ca2Ir4+2]12+, т. 28 = [Ca4Ir4+O4]4+,
т. 29 = Ca4Ir4+O6, т. 30 = [Ca4Ir4+]12+.
2.1.2.1. Направление IrO2
Взаимодействие базового кластера (Ca2Ir4+O4= ТХСn(bas) = 1 = т. 8) с Ir4+ и взаимодействие Ca2+ c Ir2O5 производят второй гомолог αm-ГС-3 ([Ca2Ir4+2 O4]4+ = ТЗКn(bas) + 1 = 2 = т. 25), который окисляясь образует второй гомолог той же ГС-3 (Ca2Ir4+2O6 = ТХСn(bas) + 1 = 2 = т. 26) на рис. 3:
Гомологическая разница Δ для αm-ГС-3 определится так:
2.1.2.2. Направление CaO
Взаимодействие базового кластера (Ca2Ir4+O4= ТХСn(bas) = 1 = т. 8) с Ca2+ и взаимодействие CaO c Ir4+ производят второй гомолог αp-ГС-4 ([Ca4Ir4+O4]4+ = ТЗКn(bas) + 1 = 2 = т. 28), который окисляясь образует второй гомолог той же ГС-4 (Ca4Ir4+O6 = ТХСn(bas) + 1 = 2 = т.29) на рис. 3:
Гомологическая разница Δ для αp-ГС-4 определится так:
Так как (ТХСn = ТХСn = 1 + k∙Δ), (ТХСn = 1 = ТХСn(bas) – kbas∙Δ) и (n(bas) = kbas + 1), то выясняется, что при определении ТХСn = 1, вычитать формулу (Δ = Ca2O2) из формулы (Ca2Ir4+O4 =ТХСn(bas) = 1 = т. 8) нельзя. Следовательно, kbasw = 0 и n(bas) = 1. Тогда получим формулу αp-ГС-4:
2.1.3. Подсистема (Ir4+ – Ir5+ – O2-)
В подсистеме (Ir4+ – Ir5+ – O2-) кластер IrO2 взаимодействуя с Ir5+, а кластер Ir2O5 взаимодействуя с Ir4+ образуют один и тот же кластер ([Ir4+5Ir5+4O10]20+ = ТЗКn(bas) = 1 = т. 1). В свою очередь, кластеры ([Ir4+5Ir5+4O10]20+ = ТЗКn(bas) = 1 = т. 1) и ([Ir4+5Ir5+4]40+ = ДЗКn(bas) = 1 = т. 3) окисляясь образуют кластер (Ir4+5Ir5+4O20 =ТХСn(bas) = 1 = т. 2) на рис. 1, 4:
В подсистеме (Ir4+ – Ir5+ – O2-) кластер (Ir4+5Ir5+4O20 = ТХСn(bas) = 1 = т. 2) взаимодействуя с Ir5+ начинает формировать αm-ГС-5, а реагируя с Ir5+ начинает формировать αp-ГС-6 на рис. 4.
2.1.3.1. Направление Ir2O5
Взаимодействие базового кластера (Ir4+5Ir5+4O20 = ЧХСn(bas) = 1 = т. 2) с Ir5+ и взаимодействие IrO2 c Ir5+ производят второй гомолог αm-ГС-5 ([Ir4+5Ir5+8O20]20+ = ТЗКn(bas) + 1 = 2 = т. 31), который окисляясь образует второй гомолог той же ГС-5 (Ir4+5Ir5+8O30 = ЧХСn(bas) + 1 = 2 = т.32) на рис. 4:
Гомологическая разница Δ для αm-ГС-5 определится так:
Так как (ТХСn = ТХСn = 1 + k∙Δ), (ТХСn = 1 = ТХСn(bas) – kbas∙Δ) и (n(bas) = kbas + 1), то выясняется, что при определении ТХСn = 1, вычитать формулу (Δ = Ir5+4O10) из формулы (Ir4+5Ir5+4O20 = ТХСn(bas) = 1 = т. 2 ) нельзя. Следовательно, kbas = 0 и n(bas) = 1. Тогда получим формулу αm-ГС-5:
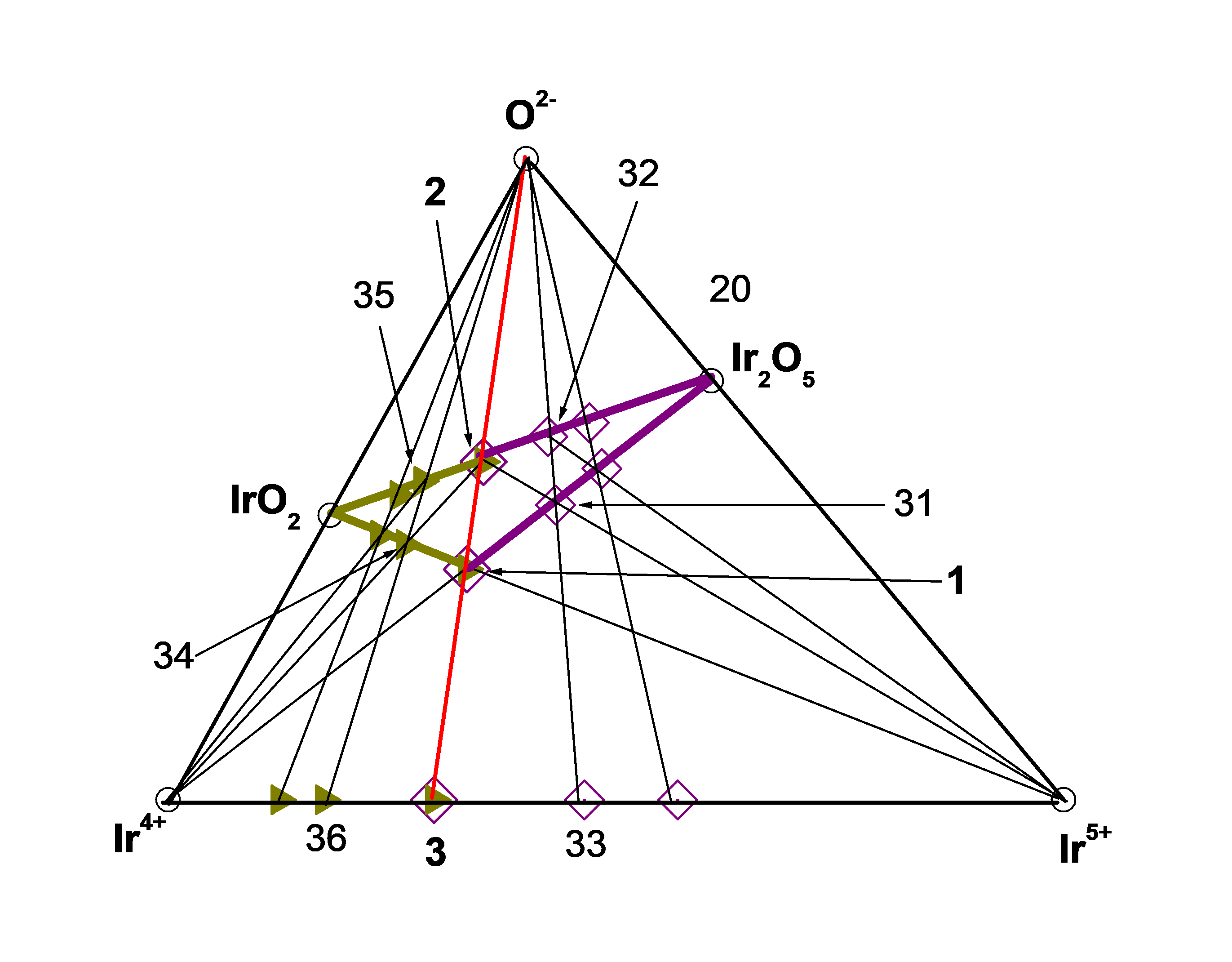
Рисунок 4 - Подсистема (Ir4+ – Ir5+ – O2–)
т. 1= ЧЗКn(bas) = 1 = [Ir4+5Ir5+4O10]20+,т. 2 = ЧХСn(bas) = 1 = Ir4+5Ir5+4O20, т. 3 [Ir4+5Ir5+4]40+,
т. 31 = [Ir4+5Ir5+8O20]20+, т. 32 = Ir4+5Ir5+8O30, т. 33 = [Ir4+5Ir5+8]60+,
т. 34 = ([Ir4+10Ir5+4O20]20+, т. 35 = Ir4+10Ir5+4O30, т. 36 = [Ir4+10Ir5+4]60+.
2.1.3.2. Направление IrO2
Взаимодействие базового кластера (Ca2Ir4+O4= ТХСn(bas) = 1 = т. 8) с Ir4+ и взаимодействие IrO2 c Ir5+ производят второй гомолог αp-ГС-6 (([Ir4+10Ir5+4O20]20+ = ТЗКn(bas) + 1 = 2 = т. 34), который окисляясь образует второй гомолог той же ГС-6 (Ir4+10Ir5+4O30 = ЧХСn(bas) + 1 = 2 = т. 35) на рис. 4:
Гомологическая разница Δ для αp-ГС-6 определится так:
Так как (ТХСn = ТХСn = 1 + k∙Δ), (ТХСn = 1 = ТХСn(bas) – kbas∙Δ) и (n(bas) = kbas + 1), то выясняется, что при определении ТХСn = 1, вычитать формулу (Δ = Ir4+5O10) из формулы (Ir4+5Ir5+4O20 =ТХСn(bas) = 1 = т. 2 ) нельзя. Следовательно, kbas = 0 и n(bas) = 1. Тогда получим формулу αp-ГС-6:
Немного о связи ТХС-гомологов с формированием ЧГС: полученные выше кластеры в виде (ДЗКn(bas) = 1 = т. 3, т. 6 и т. 9) взаимодействуя с недостающим в их составе ионом ХЭ, Ca2+, Ir4+ и Ir5+, соответственно, образуют в подсистеме (Ca2+-Ir4+-Ir5+) кластер (ТЗКn(bas) = 1 = т. 11), который состоит только из положительно заряженных ионов ХЭ, Ca2+, Ir4+ и Ir5+ на рис. 1. Кластер (ТЗКn(bas) = 1 = т. 11) окисляясь образует четырех компонентный кластер (Ca20Ir4+10Ir5+8O60 = ЧХСn(bas) = 1 = т. 10), который является базовым при формировании трех ГС, развивающихся в сторону CaO, IrO2 и Ir2O5 на рис. 1:
Уравнения реакций (34) и (35) говорит об участии двух компонентных кластеров в виде (ДЗКn(bas) = 1 = т. 3, т. 6 и т. 9) в формировании первых четырех компонентных ГС начиная с образования первого гомолога (Ca20Ir4+10Ir5+8O60 = ЧХСn(bas) = 1 = т. 10).
Кроме этого, кластеры в виде (ДЗКn(bas) = 1 = т. 3, т. 6 и т. 9) взаимодействуя с активированными CaO, IrO2 и Ir2O5, соответственно, образуют в системе (Ca2+ – Ir4+– Ir5+– O2-) общий для них активированный кластер ([Ca20Ir4+10 Ir5+8O20]60+] = ЧЗКn(bas) = 1 = т. 12) на 1, также этим подтверждая участие (ДЗКn(bas) = 1 = т. 3, т. 6 и т. 9) в формировании ЧГС:
Рассматривая формирование ЧГС из рис. 1 можно увидеть, что полученные в уравнениях реакций (23), (1) и (12) кластеры ТЗКn(bas) = 1 = т. 1, т. 4 и т. 7, соответственно, могут взаимодействовать с недостающим в их составе ионом ХЭ, Ca2+, Ir4+ или Ir5+, соответственно, с образованием одного общего для них кластера (ЧЗКn(bas) = 1 = т. 12), что говорит об участии ТЗКn(bas) = 1 = т. 1, т. 4 и т. 7 в формировании ЧГС на рис. 1:
Геометрические особенности треугольника и треугольной пирамиды заключаются, в частности, в том, что только в одном случае для рассматриваемых выше реакций (1)-(12) все отрезки {(т. 1 = ТЗКn(bas) = 1) – Ca2+}, {(т. 4 = ТЗКn(bas) = 1) – Ir4+},{(т. 7 = ТЗКn(bas) = 1) – Ir5+}, {(т. 3 = ТЗКn(bas) = 1) – CaO}, {(т. 6 = ТЗКn(bas) = 1) – IrO2} и {(т. 9 = ТЗКn(bas) = 1) – Ir2O5} пересекаются только в одной точке, (т. 12 = ЧЗКn(bas) = 1) на рис. 1. Это соответствует случаю, когда все три ЧГС основаны базовым кластером (Ca20Ir4+10Ir5+8O60 = ЧХСn(bas) = 1 = т. 10), который, в свою очередь, образован взаимодействием трех компонентных базовых кластеров (Ca5Ir5+2O10 = ТХСn(bas) = 1 = т. 5) c IrO2, (Ca2Ir4+O4 = ТХСn(bas) = 1 = т. 8) c Ir2O5 и (Ir4+5Ir5+4O20 =ТХСn(bas) = 1 = т. 2) с CaO. В тоже время, ТХСn(bas) = 1 = т. 5, т. 8 и т. 2, полученные согласно уравнениям реакций (2) и (13) и (24) также могут взаимодействовать с недостающим в их составе ДХС-окислом, IrO2 и Ir2O5 и CaO, соответственно, с образованием одного общего для них базового кластера (ЧХСn(bas) = 1 = т. 10) на рис. 1:
Причем, кластер (ЧЗКn(bas) = 1 = т. 12) связан с кластером (ЧХСn(bas) = 1 = т. 10) реакцией окисления на рис. 1:
3. Заключение
Трех компонентные подсистемы (Ir4+ – Ir5+ – O2–), (Ca2+ – Ir5+ – O2–) и (Ca2+ – Ir4+ – O2–) являются частью четырех компонентной системы (Ca2+ – Ir4+– Ir5+ – O2–). Трех компонентные подсистемы представляются треугольником, в углы основания которого помещены положительно заряженные ионы ХЭ, а в его вершину помещен анион. Геометрические особенности треугольника, представляющего трех компонентную подсистему, позволяют рассчитать химические взаимодействия членов подсистемы и выявить среди них те, которые участвуют в формировании ТГС. Это удается осуществить в результате рассмотрения цепи последовательно протекающих химических взаимодействий ионов ХЭ и более сложных по составу ТХС и ТЗК, начиная с образования двух компонентных ХС, CaO, IrO2 и Ir2O5. В результате, для трех компонентных подсистем расчетом определены формулы шести ГС: Ca5Ir5+2nO5n + 5, Ca5nIr5+2O5n + 5, Ca2Ir4+nO2n + 2, Ca2nIr4+O2n + 2, Ir4+5Ir5+4nO10n + 10 и Ir4+5nIr5+4O10n + 10. Причем известные из экспериментальных работ , и соединения (Ca2Ir4+O4 = ТХСn = 1 = т. 8) и (Ca2Ir4+2O6 = ТХСn = 2 = т. 26) принадлежат αm-ГС-3 Ca2Ir4+nO2n + 2, а соединения (Ca2Ir4+O4 = ТХСn = 1 = т. 8) и (Ca4Ir4+O6 = ТХСn = 2 = т. 29), принадлежат αp-ГС-4, Ca2nIr4+O2n + 2 (рис. 3). Все они получены экспериментально и известны как термо- и кислотоустойчивые катализаторы для выделения кислорода в кислой среде , , . Как выяснилось, члены трех компонентных подсистем принимают участие в формировании четырех компонентных ГС системы (Ca2+ – Ir4+– Ir5+ – O2–).
Сказанное выше в соответствии с последовательным чередованием реакций взаимодействия компонент системы ХЭ, начиная с образования ДХС-окислов, CaO, IrO2 и Ir2O, формируются первые три ЧГС, которые развиваются в направлении CaO, IrO2 и Ir2O5. Первые ЧГС формируются в подсистемах (т. 3 – Ca2+ – O2-) — направление CaO, (т. 6 – Ir4+ – O2-) — направление IrO2 и (т. 9 – Ir5+ – O2-) — направление Ir2O5 (рис. 1). Эти первые ЧГС основаны базовыми кластерами (ЧХСn(bas) = 1 = т. 10 = Ca20Ir4+10Ir5+8O60) и (ЧЗКn(bas) = 1 = т. 12 = [Ca20Ir4+10 Ir5+8O20]60+).
