SYNTHESIS OF PYRAZOLE AND 1,2,3-TRIAZOLE BASED ON N-MALEOPIMARIMIDE-SUBSTITUTED AMINOHEXANOIC ACID
SYNTHESIS OF PYRAZOLE AND 1,2,3-TRIAZOLE BASED ON N-MALEOPIMARIMIDE-SUBSTITUTED AMINOHEXANOIC ACID
Abstract
Plant terpenes and their derivatives are a promising class of natural compounds whose biological activity has been studied by scientists around the world over the past two decades. Maleopimaric acid, obtained from forest chemical raw materials using the Diels-Alder reaction, is a promising starting material for the synthesis of bioactive substances. As a result of 1,3-dipolar cycloaddition of diazomethane and methyl-2-azidoacetate to allenoate obtained from the derivative of maleopimarimide-substituted aminohexanoic acid under Wittig reaction conditions, we have obtained for the first time hybrid potentially bioactive compounds containing a diterpene residue and pharmacophore pyrazole and triazole rings. It is demonstrated that the interaction of diazomethane with 1,2-dienoate in the presence of triethylamine proceeds regiospecifically only by one multiple bond of the allene fragment conjugated to the ester group.
1. Введение
Исследования биоактивности растительных терпенов и их производных, активно проводимые в течение последних двадцати лет , демонстрируют значительный потенциал этого класса природных соединений. Особое внимание привлекает малеопимаровая кислота (1) (МПК) – легкодоступное вещество, получаемое из возобновляемого лесохимического сырья путем реакции Дильса-Альдера левопимаровой кислоты с 2,5-фурандионом . Молекула МПК, содержащая гидрофенантреновое кольцо, двойную связь, карбоксильную и ангидридную группы, находит широкое применение в производстве лакокрасочных материалов и полимеров , . Кроме того, она рассматривается как перспективный исходный материал для получения биологически активных соединений , , и хиральных лигандов . Данное исследование посвящено синтезу потенциально биоактивных соединений через 1,3-диполярное циклоприсоединение диазометана и метил-2-азидоацетата к алленоату, полученному из N-малеопимаримидзамещенной аминогексановой кислоты.
2. Методы и принципы исследования
ИК спектры записывали на приборе IR-Prestige-21 (Fourier Transform Spectrophotometer – Shimadzu) в тонком слое или вазелиновом масле. Спектры ЯМР были получены на спектрометре Bruker-AM 500 с рабочей частотой 500.13 МГц (1Н), 125.76 МГц (13С), внутренний стандарт – тетраметилсилан (ТМС). Для корректного отнесения сигналов в спектрах ЯМР для продуктов реакций применялись методы гомо- и гетероядерной двумерной корреляции COSY, NOESY, HSQC и HMBC. За ходом реакции следили при помощи использования тонкослойной хроматографии на пластинках Sorbfil ПТСХ-АФ-А, вещества обнаруживали с помощью УФ-облучения, паров йода, опрыскивания пластинок раствором нингидринового проявителя с последующим нагреванием при 100-110°С. Элементный анализ был сделан при помощи прибора EURO EA-3000 CHN. Продукты реакции выделяли при помощи колоночной хроматографии на силикагеле «Chemapol» с размером частиц 40/100 мкм и 100/160 мкм.
Данные элементного состава всех соединений соответствовали вычисленным.
Метиловый эфир малеопимаровой кислоты получали по известной методике , физико-химические характеристики соответствовали литературным данным. Кислоту 1 синтезировали по методике, которая была описана в работах , . Получение метил-2-азидоацетата описано в .
2.1. Мeтил-12-изопропил-2-(8'-метокси-8'-оксоокта-5',6'-диен-1'-ил)-6,9a-диметил1,3-диоксогексадекагидро-3b,11-этенонафто[2,1-e]изоиндол-6-карбоксилат (4)
Выход 70%. Прозрачный маслообразный продукт. ИК (в.м.) ν см-1: 1695, 1767, 1960. ЯМР 1H (CDCl3, δ м.д., J/Hz): 0,57 (с, 3H, H-17), 0,89 и 0,93 (д, 6H, J = 6,8, Н-15, 16), 0,96 и 1,42 (м, 2H, H-9), 1,12 (с, 3H, H-18), 1,18 и 1,46 (м, 2H, H-5), 1,22 и 1,53 (м, 2H, 93 H-10), 1,35 (м, 1H, H-9b); 1,47-1,53 (м, 2H, H-8), 1,50 и 1,63 (м, 2H, H-7), 1,60 и 2,47 (м, 1H, H-4), 1,67 (м, 1H, H-5a), 1,72 (м, 2Н, H-3'), 1,75 (м, 2Н, H-2'), 2,10 (м, 1H, J = 6,8, H-14), 2,15 (м, 2Н, Н-4'), 2,38 (д, 1H, J = 8,0, H-3a), 2,75 (дд, 1H, J = 8,0, J = 2,9, H-11a), 3,03 (с, 1H, H-11), 3,30 (т, 2H, J = 7,1, H-1'), 3,65 (с, 3H, H-20), 3,70 (с, 3H, H9'), 5,37 (с, 1H, H-13), 5,56 (с, 1Н, Наллен-7'), 5,58 (т, 1H, J = 7,6, Hаллен-5'). ЯМР 13C (CDCl3, δ м.д.): 15,63 (C17), 16,73 (C18), 17,03 (C8), 19,83 (C15), 20,63 (C16), 21,76 (C5), 25,82 (C3'), 26,87 (C2'), 27,11 (C4'), 27,53 (C10), 32,58 (C14), 35,28 (C4), 35,63 (C11), 36,71 (C7), 37,67 (C9a), 37,86 (C1'), 38,14 (C9), 40,71 (C3b), 44,92 (C11a), 47,13 (C6), 49,53 (C5a), 51,90 (C20), 51,96 (С9'), 52,28 (C3a), 54,24 (C9b), 88,12 (C5' аллен), 94,82 (С7'аллен), 124,32 (C13), 146,94 (C12), 166,47 (C8'), 177,31 (C3), 178,49 (C1), 179,14 (C19), 212,30 (C6'). С34Н47NO6. Масс-спектр: m/z 566[MH] + . Вычислено М 565.
2.2. Мeтил-12-изопропил-2-(8'-метокси-8'-оксоокта-5',6'-диен-1'-ил)-6,9a-диметил1,3-диоксогексадекагидро-3b,11-этенонафто[2,1-e]изоиндол-6-карбоксилат (5)
К охлажденному раствору алленоата (0,5 г) в 20 мл дихлорметана, поддерживаемому при 0°C, добавили эквимолярное количество триэтиламина. После этого ввели пятикратный избыток свежеприготовленного раствора диазометана в дихлорметане и постепенно довели температуру смеси до комнатной. Реакционную массу перемешивали с помощью магнитной мешалки при комнатной температуре в течение 6 часов. После удаления растворителя путем выпаривания конечные продукты выделили с помощью колоночной хроматографии на силикагеле, используя смесь петролейного эфира и этилацетата (3:1) в качестве элюента.
Выход 46%. Прозрачный маслообразный продукт. ИК (в.м.) ν см-1 : 1695, 1767, 1960. ЯМР 1H (CDCl3, δ м.д., J/Hz): 0,57 (с, 3H, H-17), 0,89 и 0,93 (д, 6H, J = 6,8, Н-15, 16), 0,96 и 1,42 (м, 2H, H-9), 1,12 (с, 3H, H-18), 1,18 и 1,46 (м, 2H, H-5), 1,22 и 1,53 (м, 2H, 93 H-10), 1,35 (м, 1H, H-9b); 1,47-1,53 (м, 2H, H-8), 1,50 и 1,63 (м, 2H, H-7), 1,60 и 2,47 (м, 1H, H-4), 1,67 (м, 1H, H-5a), 1,72 (м, 2Н, H-3'), 1,75 (м, 2Н, H-2'), 2,10 (м, 1H, J = 6,8, H-14), 2,15 (м, 2Н, Н-4'), 2,38 (д, 1H, J = 8,0, H-3a), 2,75 (дд, 1H, J = 8,0, J = 2,9, H-11a), 3,03 (с, 1H, H-11), 3,30 (т, 2H, J = 7,1, H-1'), 3,65 (с, 3H, H-20), 3,70 (с, 3H, H9'), 5,37 (с, 1H, H-13), 5,56 (с, 1Н, Наллен-7'), 5,58 (т, 1H, J = 7,6, Hаллен-5'). ЯМР 13C (CDCl3, δ м.д.): 15,63 (C17), 16,73 (C18), 17,03 (C8), 19,83 (C15), 20,63 (C16), 21,76 (C5), 25,82 (C3'), 26,87 (C2'), 27,11 (C4'), 27,53 (C10), 32,58 (C14), 35,28 (C4), 35,63 (C11), 36,71 (C7), 37,67 (C9a), 37,86 (C1'), 38,14 (C9), 40,71 (C3b), 44,92 (C11a), 47,13 (C6), 49,53 (C5a), 51,90 (C20), 51,96 (С9'), 52,28 (C3a), 54,24 (C9b), 88,12 (C5' аллен), 94,82 (С7'аллен), 124,32 (C13), 146,94 (C12), 166,47 (C8'), 177,31 (C3), 178,49 (C1), 179,14 (C19), 212,30 (C6').
2.3. Meтил-12-изопропил-2-{5''-[4'-(метоксикарбонил)-1'-(2'-метокси-2'-оксоэтил)-1'H-1',2',3'-триазол-5'-ил]пентил}-6,9a-диметил-1,3-диоксогексадекагидро-3b,11-этенонафто[2,1-e]изоиндол-6-карбоксилат (6)
0,01 Моль аллена и 0,02 моль метил-2-азидаацетата кипятили в 15 мл толуола в течение 10 ч. Затем реакционную массу упарили, остаток хроматографировали на силикагеле (петролейный эфир – этилацетат 2:1).
Выход 40%, маслообразное вещество желтого цвета. ИК ν см-1: 1244, 1373, 1401, 1437, 1693, 1721, 1755. ЯМР 1H (CDCl3, δ м.д., J/Hz): 0,55 (с, 3H, H-17), 0,87 (д, 3H, J = 6,6, H-15), 0,91 (д, 3H, J = 6,6, H-16), 0,94 (м, 1H, Hax-9), 1,11 (с, 3H, H-18), 1,15 (м, 1H, Heq-5), 1,18 (м, 2Н, H-2''), 1,23 (м, 1H, Heq-10), 1,37 (м, 1H, H-9b), 1,42 (м, 1H, Heq-9), 1,47-1,55 (м, 2H, Hгем-8), 1,48 (м, 1H, Hax-5), 1,51 (м, 1H, Heq-7), 1,54 (м, 2Н, H-3''), 1,57 (м, 1H, Hax-10), 1,60 (м, 1H, Hax-4), 1,63 (м, 1H, Hax-7), 1,66 (м, 2Н, H-4''), 1,73 (м, 1H, H-5a), 2,11 (м, 1H, J = 6,8, H-14), 2,38 (д, 1H, J = 8,1, H-3a), 2,45 (м, 1H, Heq-4), 2,73 (дд, 1H, J = 8,1, H-11a), 2,88 (т, 2H, J = 8, H-5''), 3,00 (с, 1H, H-11), 3,28 (т, 2H, J = 7,1, H-1''), 3,63 (с, 3H, H-20), 3,77 (с, 3H, H-10'), 3,92 (с, 3H, H-8'), 5,15 (с, 2H, H-6'), 5,30 (с, 1H, H-13). ЯМР 13C (CDCl3, δ м.д.): 15,63 (C17), 16,72 (C18), 17,00 (C8), 19,84 (C15), 20,63 (C16), 21,09 (C2''), 21,76 (C5), 22,93 (C5''), 26,14 (C3''), 27,28 (C4''), 27,51 (C10), 32,59 (C14), 35,27 (C4), 35,62 (C11), 36,70 (C7), 37,48 (C1''), 37,66 (C9a), 38,09 (C9), 40,69 (C3b), 44,90 (C11a), 47,12 (C6), 48,74 (С6'), 49,48 (C5a), 51,96 (C20), 52,00 (С10'), 52,26 (C3a), 53,15 (С8'), 54,18 (C9b), 124,26 (C13), 136,12 (С4'), 143,23 (С5'), 146,94 (C12), 161,73 (С9'), 166,31 (С7'), 177,63 (C3), 178,64 (C1), 179,23 (C19). C37H52N4O8. Масс-спектр: m/z 681 [MH]+, 679 [MH]-. Вычислено М 680.
3. Основные результаты
Хлорангидрид кислоты 2, который был полученный из метилмалеопимаримидной кислоты 1 реакцией с оксалилхлоридом, под действием триэтиламина превращается в кетен 3. Взаимодействие последнего in situс метил(трифенилфосфоранилиден)ацетатом в реакции олефинирования по Виттигу приводит к образованию алленоата 4 с выходом 70%. Структура полученных соединений подтверждена методами физико-химического анализа. Структуры полученных соединений доказаны с помощью физико-химических методов анализа. Для алленоата 4 в спектре ЯМР 13С информативными являются сигналы двух терминальных алленовых углеродных атомов при δс 88,15 и 94,82 м.д., и центрального алленового углеродного атома, проявляющийся в слабом поле при δс 212,30 м.д. В спектре ЯМР 1Н сигнал протона алленового фрагмента идентифицируется при δн 5,5 м.д.
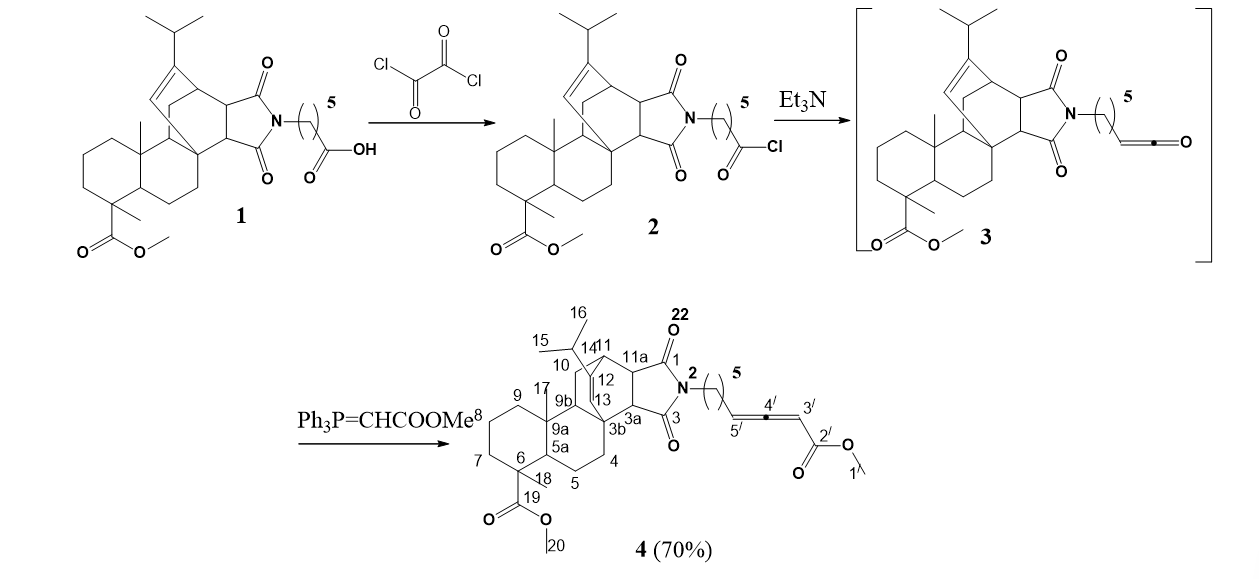
Рисунок 1 - Получение алленоата 4
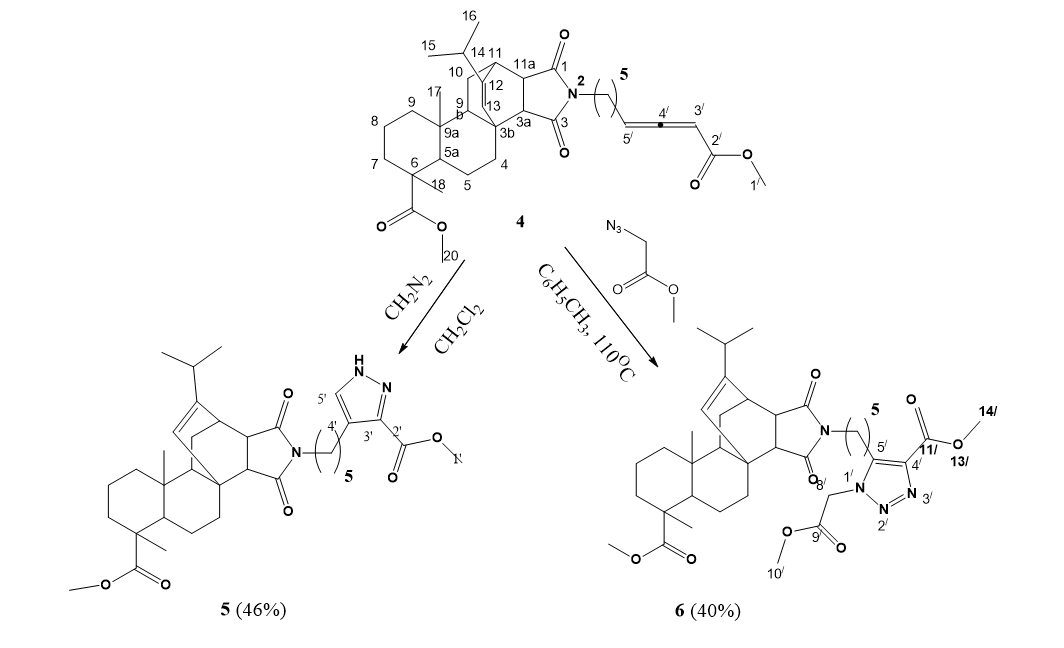
Рисунок 2 - Получение пиразола 5 и триазола 6 из алленоата 4
4. Заключение
Таким образом, нами впервые синтезированы гибридные соединения, которые содержат дитерпеновый остаток и фармакофорные пиразольное и триазольное кольца путем 1,3-диполярного циклоприсоединения диазометана или метил-2-азидоацетата к алленоату, полученного из N-малеопимаримидзамещенной аминокислоты.
